Le zinc (symbole chimique Zn) a une belle promesse : être peu cher. Le zinc est abondant et on peut l'extraire plus facilement que du lithium par exemple. Mais, quand on fait des batteries au zinc, on utilise pour le moment des sels souvent toxiques et polluants dans l'électrolyte. C'est là que le bât blesse.
Des chercheurs de l'Ecole Polytechnique de Zurich (ETH Zurich) ont publié début mars une étude sur la création d'un électrolyte sans sels toxiques qui permettraient tout de même de bonnes performances pour les batteries zinc. Titrée "Creating water-in-salt-like environment using coordinating anions in non-concentrated aqueous electrolytes for efficient Zn batteries", cette étude de plus de 10 auteurs présente donc une solution à base d'eau qui n'utilise donc pas ou peu de produits toxiques.
Des acétates, moins concentrés
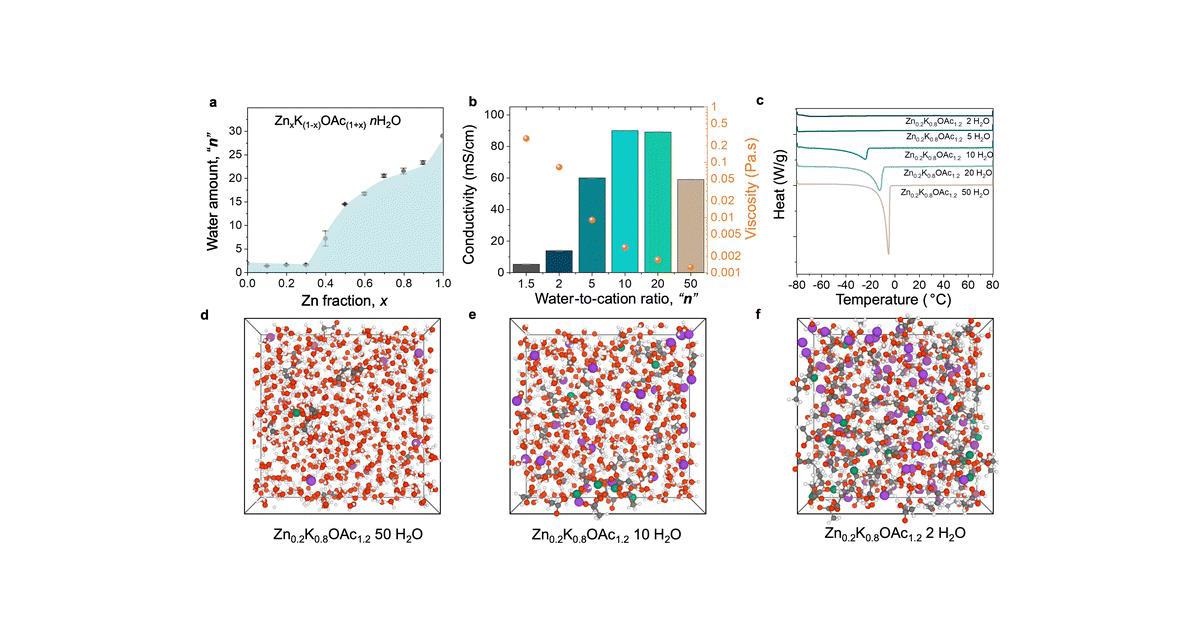
Contrairement aux premières pistes suivies qui mettaient une concentration très importante de sels, ici, l'approche est de trouver la concentration idéale. Et cette concentration peut être très faible selon les chercheurs, en choisissant bien les ions utilisés. "In conclusion, we demonstrate that coordinating anions such as acetate can create a WIS-like coordination environments in electrolytes that are relatively dilute. Using XAS and MD simulations we show that in a non-concentrated state, the Zn2+ coordination environment is already WIS-like, with Zn2+ ions being predominantly coordinated by acetate rather than water".
Ces concentrations faibles permettent aussi de limiter le phénomène de dendrite. Les dendrites, ce sont des dépôts de métal pur (ici zinc) qui finissent par créer comme des radicelles et créent des ponts entre l'anode et la cathode, faisant ainsi un court-circuit. C'est une maladie des batteries qui limitent énormément leur durée de vie, et présente un fort risque d'incendie.
Pour des batteries stationnaires
En utilisant une concentration d'électrolyte plus faible, cela diminue l'empreinte écologique de la batterie. Surtout, les sels utilisés dans la solution aqueuse sont principalement des acétates. Un acétate est un sel d'acide acétique. L'acide acétique, vous en avez tous déjà ingéré : c'est le vinaigre. Avec la concentration faible, le phénomène de dendrite est limité et l'électrolyte conserve ses propriétés plus longtemps. Là encore c'est primordial pour de bonnes batteries.
Pour le moment, ces résultats ont été obtenus en laboratoire sur un petit prototype. Le but désormais est de monter en taille et de confronter ses résultats avec des batteries utilisables au quotidien. L'intérêt du zinc est en plus de ne pas être trop cher, d'avoir une industrie du recyclage déjà en place et efficace. En revanche, on ne devrait pas trouver ces batteries dans nos voitures. La piste privilégiée est de les intégrer dans le réseau, ou à domicile. Ce serait des batteries tampon permettant par exemple à un particulier de produire et stocker son électricité la journée et la consommer (ou recharger son véhicule électrique) le soir ou la nuit.
En effet, en matière de densité, les batteries lithium-ion sont 3 à 4 fois plus denses que les batteries zinc. Ainsi en voiture, il en faudrait 3 à 4 fois plus qu'actuellement. Impensable. Par contre, au domicile ou dans l'industrie, il y a moins de souci de place et de poids. Mais une batterie tampon qui coûterait largement moins cher et surtout polluerait moins qu'une lithium-ion serait forcément plus largement adoptée. A suivre.
Pour ceux qui veulent lire l'étude, c'est par ici.